医疗器械注册自检有什么要求?
2022-07-23
医疗器械注册自检有什么要求?企业在采用医疗器械注册自检方式时,有哪些需要注意的事项?可参考本文:医疗器械注册自检质量管理体系现场检查要点。 医疗器械注册自检质量管理体系现场检查要点 ……
家庭常用医疗器械主要有哪些?
2022-07-23
随着民众文化水平的提高,越来越多可自助式使用的医疗器械进入家庭,更好的守护家庭健康。考虑到多数医疗器械是许可制上市审批模式,产品需要取得医疗器械产品注册证及医疗器械生产许可证方可上市销售,进入千千万万家庭。因此,借此机会,带大家看看家用常用医疗器械主要有哪些? 可以“家用的”医疗器械也都必须有医疗器械产品……
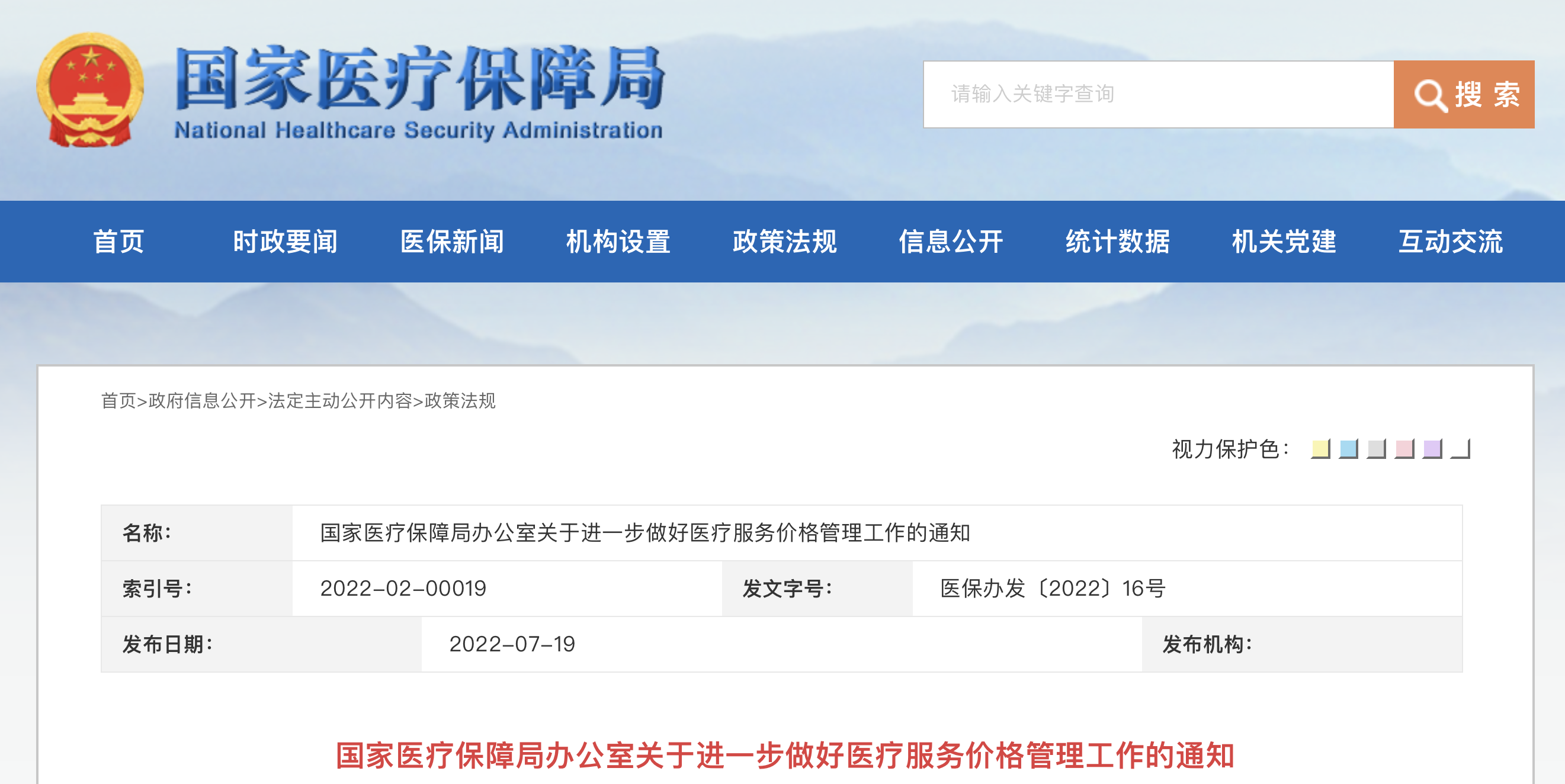
国家医保局通知:调整耗材收费!
2022-07-22
7月19日,国家医疗保障局发布《关于进一步做好医疗服务价格管理工作的通知》(以下简称《通知》),通知自印发之日起生效。 《通知》内容指出,其中提出,对技术难度大、风险程度高、确有必要开展的医疗服务项目,可适当体现价格差异。 总结新冠病毒核酸检测价格专项调整经验,按照技术劳务与……
美国医疗器械上市后监督模式
2022-07-22
一、相关法规21CFR part 803 medical device reporting(MDR 报告)21CFR part 806 medical device reports of corrections and removals(纠正移除报告)21CFR part 810 medical device reca……
日本医疗器械注册认证指南
2022-07-22
日本作为全球前三的医疗器械市场一直被认为是挑战性较高的市场,相应的其市场容量回报率也较高,由于日本本土制造业的人力成本和法规合规成本比较高,日本的医疗器械基本进口量是出口量的两倍,所以日本市场不容小觑;日本的药品和医疗器械管理是由卫生劳动和福利部(日本厚生省)(Ministry of Health,Labor and ……
江西省医疗器械产品委托灭菌方式检查要点指南(修订征求意见稿)发布
2022-07-22
19日,江西省药监局发布《江西省医疗器械产品委托灭菌方式检查要点指南(修订征求意见稿),全文如下: 江西省医疗器械产品委托灭菌方式检查 要点指南(修订征求意见稿) 本指南旨在指导和规范对江西省医疗器械注册人或注册申请人(以下简称注册人)委托灭菌实施的各类检查工作,帮助检查人员增强对医疗……
怎么确认医疗器械的使用期限和有效期?
2022-07-21
我国规定,医疗器械注册申请人/注册人需确定产品的使用期限。如何确定医疗器械的使用期限?国家药品监督管理局发布了《有源医疗器械使用期限注册技术审查指导原则》,给出了详细的确定方法。 有源医疗器械使用期限注册技术审查指导原则 有源医疗器械可实现对疾病的诊断、预防、监护和治疗等功能,为了在临床使用……
医疗电源中用作隔离的Y电容,有哪些标准要求?
2022-07-21
【问】医疗电源关于Y电容有要求一定要2个或以上Y电容串联才可以么?或者说只要满足漏电流小于0.1mA就OK? 【答】医疗电器隔离分 2MOPP模式和 2MOOP模式,2MOOP模式(操作者隔离),等同于IEC 60950-1隔离,一个Y1电容就够了,2MOPP(患者隔离),要求两个Y1电容,除非电压低于4……
射频美容类器械、灸疗类医疗器械分类界定指导原则
2022-07-21
一、射频美容类医疗器械属性界定 符合《医疗器械监督管理条例》有关医疗器械含义的射频美容类产品,应按照医疗器械管理。具体属性界定原则如下: (一)预期使用射频能量作用于人体(包括但不限于皮肤组织及皮下深层软组织等),达到局部浅表温和加热、改善血液循环等目的的射频美容类产品,应按照医疗器械管理; (二)预……
美国食品药品管理局突破性器械项目及进展情况
2022-07-19
一、什么是突破性器械项目? 突破性器械项目(Breakthrough Devices Program)是一项针对治疗或诊断危害生命或不可逆转的使人衰弱的疾病的医疗急需医疗器械和以器械为主导的组合产品的自愿性项目。 突破性器械项目的目标是根据美国食品药品管理局(以下简称FDA)保护和促进公众健康的使命,在符合……
医疗器械注册、变更、审评等共性问答汇总
2022-07-19
Q: 变更注册增加规格型号,涉及到新的强制性标准时该如何处理? 产品变更注册增加规格型号(原有A、B两个型号未发生变化,新增C、D型号),同时涉及到新的强制性标准发布或修订,原有型号是否需要针对新标准进行检测?产品技术要求是否需要增加新标准的要求? 答:许可事项变更增加新型号,对于新增强制性标准,仅需要提交证明C、D满足新的强制性标准的检测报告,不在产品技术要求中增加新强制性标准的内容。注册人应确保,自新的强制性标准实施之日起,A、B也能够满足新标准的要求。 如果在产品技术要求中增加新强
2022年6月193个医疗器械产品获批上市
2022-07-18
2022年6月,国家药品监督管理局共批准注册医疗器械产品193个。其中,境内第三类医疗器械产品139个,进口第三类医疗器械产品26个,进口第二类医疗器械产品25个,港澳台医疗器械产品3个。 2022年6月批准注册医疗器械产品目录 ……