发布人:管理员 发布时间:2025-06-14
1、政策背景速览
G家药品监督管理局2023年3月16日发布《关于GB 9706.1-2020及配套并列标准、专用标准实施有关工作的通告》(2023年第14号)明确要求:已获准注册的医疗器械产品,在产品适用GB 9706.1-2020配套专用标准实施之日起,应当在3年内完成产品GB 9706.1-2020及配套并列标准、专用标准(以下简称新版GB 9706系列标准)的变更注册。尤其值得关注的是,产品适用GB 9706.1-2020配套专用标准实施之日,将成为衡量产品延续注册是否符合新版GB 9706系列标准要求的关键时间节点。
(一) 适用产品范围
有源医疗器械
(二) 注册变更(已注册产品适用)关键时间节点
● 无专用标准的产品:
● 有强制性专用标准的产品:
以最后实施的专用标准日期为准,3年内完成变更;
示例:激光类产品专用标准GB 9706.222-2022已于2024年5月1日实施,则相关产品需在2027年5月1日前完成变更;
● 有强制性专用标准的产品:
如产品技术要求包含该推荐性标准,则以最后实施的专用标准日期为准,3年内完成变更;
若产品技术要求未包含该推荐性标准号,则由企业自愿执行,若不执行则按无专用标准处理;
特别提醒:
2025年12月31日前实施的专用标准:需在2028年12月31日前完成变更。
2025年12月31日后实施的专用标准:需在专用标准实施之日前完成变更。
(三) 变更注册要求
提交符合新版标准的检验报告(自检或第三方检测机构出具);
风险管理文件更新:需结合GB 9706.1-2020要求,补充可用性、基本性能等风险评估;
PEMS文档:若涉及可编程电子系统(PEMS),需提供软件生命周期所需的文件;
重点提醒(关联延续注册):
依据《医疗器械注册与备案管理办法》第83条,新标准实施后申请延续注册的,必须符合新标准,延续注册若未达到新标准要求,直接不予延续。
逾期未完成变更注册或变更备案,产品延续注册将面临风险:注册证失效或涉及《医疗器械监督管理条例》第八十六条的处罚。
强制标准实施后,先变更注册,再延续注册!!!
(一) 尽快评估产品适用标准
确认产品是否适用专用标准,并查询具体实施日期;
若无专用标准,则默认适用2023年5月1日的时间节点;
(二) 安排检测与文件更新
优先进行新版标准检测,尤其是EMC(YY 9706.102-2021)和安规(GB 9706.1-2020)测试;
更新产品技术要求、风险管理文件和PEMS相关文档(如适用);
(三) 规划检测周期、注册变更和延续注册时间
若产品需延续注册,建议在当前注册证有效日期前的6个月且必须在GB 9706系列强制标准实施后3年内完成变更注册,否则可能影响注册状态;
建议提前6-12个月启动变更流程,避免审评延误;
请预留充足的检验时间,GB 9706系列新版标准要求较高、送检资料要求较多、耗时较长,至少预留3个月的检验周期,建议在提交变更注册申请前至少4-6个月安排样品送检。
4、新版GB 9706系列标准实施时间表
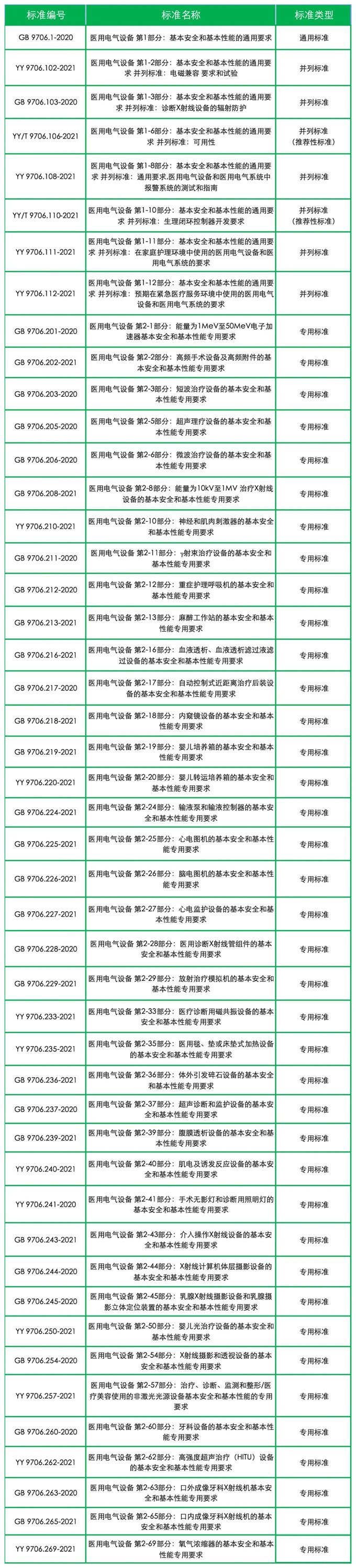
● 2023年5月1日起实施(须2026年5月1日前完成变更注册)的新版GB 9706系列标准有47项:
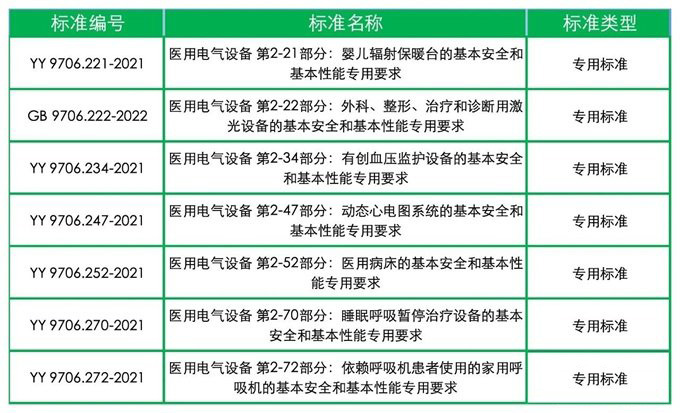
● 2024年5月1日起实施(须2027年5月1日前完成变更注册)的的新版GB 9706系列标准有7项:
● 2024年8月1日起实施(须2027年8月1日前完成变更注册)的新版GB 9706系列标准有1项:

● 2025年5月1日起实施(须2028年5月1日前完成变更注册)的新版GB 9706系列标准有1项:

● 2025年6月1日起实施(须2028年6月1日前完成变更注册)的新版GB 9706系列标准有3项:

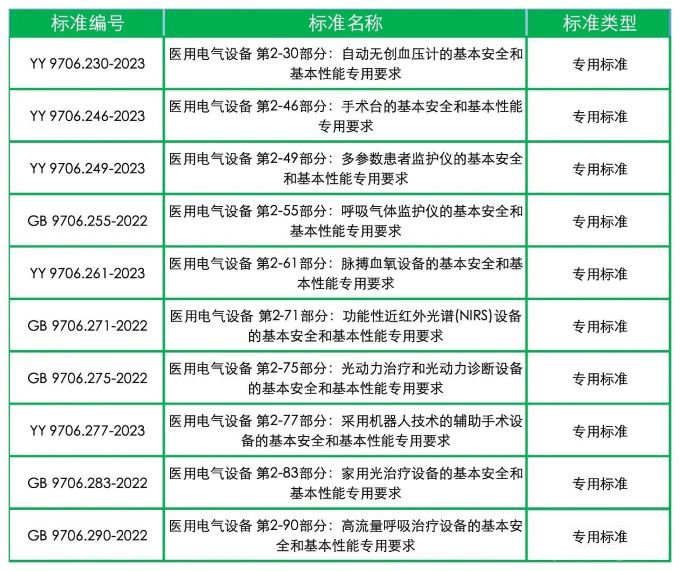
● 2026年1月1日、15日起实施(须该实施日期前完成变更注册)的新版GB 9706系列标准有10项:
● 2026年5月1日起实施(须该实施日期前完成变更注册)的新版GB 9706系列标准有6项:

● 2028年3月1日起实施(须该实施日期前完成变更注册)的新版GB 9706系列标准有1项:

时间紧迫,行动刻不容缓!确保您的产品顺利过渡到新版GB 9706系列标准要求,保障产品注册证的持续有效,是维持市场准入的关键。